Vesi on molekyyli, jossa yksi happiatomi ja kaksi vetyatomia ovat kiinni toisissaan.
Nykyisen käsityksen mukaan avaruudessa on paljon vesimolekyylejä.
Miten happi- ja vetyatomit ovat kiinni toisissaan?
Wikipedia käyttää vettä kuvatessaan vuonna 1939 käyttöön otetettua termiä kovalenttisidoksi (covalent bond). Atomeiden ytimiä kiertävät yhteiset elektronit, kuten piirroksen vetymolekyylissä H2. Valenssit täsmäävät (1 ja 1), joten vetymolekyyli on elektronisesti neutraali.
 |
| Kovalenttisidos H2 kuva wikimedia |
Vetysidos
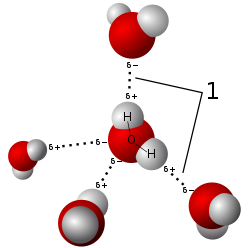 |
| Vesimolekyylien välinen vetysidos kuva wikimedia |
Tämä on hankalaa hieman hankalaa kaltaiselleni amatöörille, joten sen sijaan että kirjoitan läpiä päähäni, annan asiantuntijan selvittää ytimekkäästi asian ydintä
A hydrogen bond is the attraction between the lone pair of an electronegative atom and a hydrogen atom that is bonded to either nitrogen, oxygen, or fluorine.Veden kemiallinen rakenne, sen atomien ja molekyylien väliset suhteet, antavat sille ominaisuuksia. Tässä mainitaan ainoastaan korkea kiehumispiste. Erityisen jännittävä ja merkittävä on veden outo käyttäytyminen nollapisteen tuntumassa, joka estää esimerkiksi järvien jäätymisen pohjaa myöten ja kalojen joukkopakastumisen. Varmasti veden ominaisuuksista ja rakenteista on kirjoitettu hyvin paljon alan kirjallisuudessa.
The hydrogen bond is often described as a strong electrostatic dipole-dipole interaction.
However, it also has some features of covalent bonding: it is directional, stronger than a van der Waals interaction, produces interatomic distances shorter than the sum of van der Waals radius, and usually involves a limited number of interaction partners, which can be interpreted as a kind of valence.
Intermolecular hydrogen bonding is responsible for the high boiling point of water (100 °C) compared to the other group 16 hydrides, which have no hydrogen bonds.
Intramolecular hydrogen bonding is partly responsible for the secondary, tertiary, and quaternary structures of proteins and nucleic acids. It also plays an important role in the structure of polymers, both synthetic and natural.
wikipedia
Kvanttimekaniikka
Ei tässä vielä kaikki vetysidoksesta ja veden rakenteesta. Molekyylien välisiä erilaisia vetovoimia voidaan katsella myös toisella tavalla kvanttimekaniikan näkökulmasta.
Intermolecular forces observed between atoms and molecules can be described phenomenologically as occurring between permanent and instantaneous dipoles, as outlined above.Alussa teemamme edellyttää paneutumista kvanttimekaniikkaan, mutta jääköön tässä viitteeksi tuleville harjoituksille!
Alternatively, one may seek a fundamental, unifying theory that is able to explain the various types of interactions such as hydrogen bonding, van der Waals forces and dipole-dipole interactions. Typically, this is done by applying the ideas of quantum mechanics to molecules, and Rayleigh–Schrödinger perturbation theory has been especially effective in this regard.
When applied to existing quantum chemistry methods, such a quantum mechanical explanation of intermolecular interactions, this provides an array of approximate methods that can be used to analyze intermolecular interactions.
wikipedia
Teologinen kommentti
Vesi on niin ihmeellinen aine, että ei ole ihme, että vesi on niin olennainen asia Raamatussa ja kristillsessä kirkossa, kasteen vesi Jordanilla, elämän vesi Syykarin kaivolla!

Ei kommentteja:
Lähetä kommentti